医药魔方0692017-8-288月25日,FDA批准了第2个Humira(阿达木单抗)f仿制药上市,来自勃林格殷格翰的Cyltezo(adalimumab-adbm,40 mg/0.8 mL)。批准的适应症包括成人中重度活动性类风湿关节炎、活动性银屑病关节炎、活动性强直性脊柱炎、中重度活动性克罗恩病和溃疡性肠炎、中重度斑块状银屑病,以及4岁以上青少年的多关节型幼年特发性关节炎。
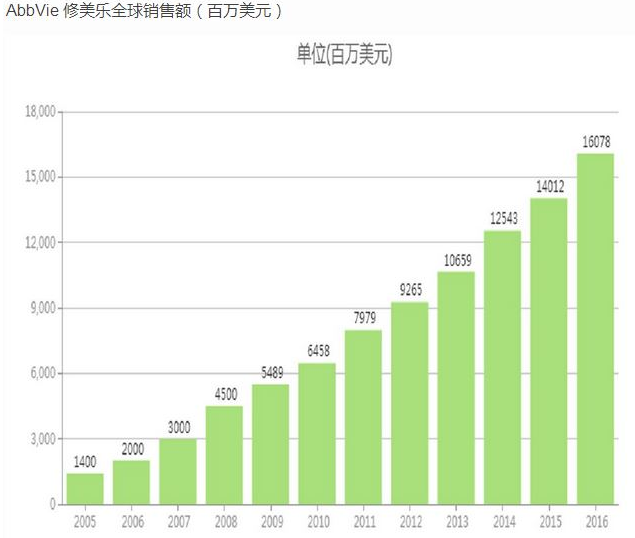
Humira是全球第一个上市的抗TNF-α药物,自2002年首次获得FDA批准上市以来,已经累计创造了近1000亿美元的销售收入,而且直到今天还以每年两位数的增幅刷新单只药品的年度销售记录。Humira在2016年的全球销售额是160.78亿美元,今年上半年的销售额是88.34亿美元,预计2017年可以达到180亿美元。
安进的Amjevita(adalimumab-atto)是FDA批准的第1个Humira仿制药,早在2016/9/23就获得了批准,不过由于AbbVie与安进的专利诉讼仍未解决,安进目前仍未在美国上市销售Amjevita。8月初,勃林格殷格翰也遭到了AbbVie的起诉,被指控侵犯Humira的74项专利,因此勃林格殷格翰短期内应该也不会上市销售Cyltezo。
由于受到超过100项专利的保护,Humira并未受到生物类似物的冲击,今年上半年在美国市场的销售额也丝毫未受影响,还增加了20%(58.97亿美元)。AbbVie甚至自信其专利保护期可以持续到2022年。
不过随着仿制药企业的轮番冲击和诉讼数量的显著增加,AbbVie和美国专利商标局的压力都会越来越大。花旗银行分析师Andrew Baum认为:“阿达木单抗类似物上市的时间会比AbbVie预想的要快,Humira的销售额预计在2018年达到峰值,之后开始下滑,2022年会下降至60亿美元左右”。
药械网是由莆田市国企控股并领衔投资一个亿打造的药械产业互联网平台,是省市政府重点扶持的平台经济龙头企业。主要为药械厂商和医疗机构提供一站式交易撮合、技术系统、销售总代、托管服务和供应链金融等服务,帮助医药产业链上下游企业降低采购、时间、资金、人员、损耗成本 【详情】>>

每天几分钟,知晓医药事

国家监管
国家食品药品监督管理总局认证

正品保障
严格资质把关 100%正品 值得信赖

价格实惠
最大限度压缩中间环节费用

专业客服
1对1客服,为您排忧解难

Copyright 2020 yaoxie.com 互联网药品信息服务资格证书(闽)-经营性-2019-0023 互联网药品交易服务资格证书-国A20150004
闽ICP备14018699号-4 增值电信业务经营许可证 闽B2-20140006 闽公网安备35030502000131号
医疗器械网络交易服务第三方平台备案凭证备案编号:(闽)网械平台备字(2018)第00001号