低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)使用说明书
[产品名称]
通用名称:低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)
英文名称: Low Density Lipoprotein Cholesterol Kit
英文简称:LDL-C Kit
[包装规格]
剂型:液体双剂型
R1:60ml×4 R2:20ml×4 校准品:1ml×1
R1:50ml×3 R2:25ml×2 校准品:1ml×1
R1:60ml×2 R2:20ml×2 校准品:1ml×2
[预期用途]
本试剂用于体外定量测定人血清中低密度脂蛋白胆固醇的浓度。
血液中的脂蛋白是脂肪(胆固醇、甘油三酯等)和载脂蛋白的复合物,是转运胆固醇的重要形式。脂蛋白主要分高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、 极低密度脂蛋白(VLDL)和乳糜微粒(CM)四种形式。LDL是一组不均一的富含胆固醇的脂蛋白颗粒。LDL主要参与将胆固醇运送至外周细胞,作用于动脉内膜形成动脉粥样硬化斑块。众多流行病学、遗传学与临床研究证实,血清低密度脂蛋白胆固醇(LDL-C)水平与动脉粥样硬化(AS)、冠心病(CHD)的发生率呈正相关,通常以高LDL-C作为CHD的首要致病因素。测定人血清低密度脂蛋白胆固醇(LDL-C)含量是判别高脂血症,如动脉粥样硬化、冠心病、高血压症发生危险程度的重要指标,也是极具市场的常规临检项目之一。
血清低密度脂蛋白胆固醇测定方法较多,本试剂采用清除法。
[检验原理]
反应分两步进行:
第一步:R1中聚阴离子与LDL形成复合物,在表面活性剂1作用下,不与胆固醇酶试剂反应。而其它脂蛋白(CM,VLDL-C,HDL-C)则被酶试剂水解产生H2O2,在缺乏偶联剂时被消耗而不显色。
第二步:R2中表面活性剂2使LDL释放CHO,在酶试剂与偶联剂作用下生成紫色化合物,最大光吸收在550nm左右,吸光度与标本中低密度脂蛋白胆固醇浓度成正比。反应式如下:

[主要组成成份]
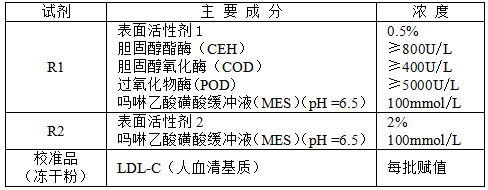
说明:
1.不同批号的试剂不能混用;新打开的试剂不宜与已用过的试剂混合在一起,否则易造成试剂稳定性下降。
2.低密度脂蛋白胆固醇校准品定值溯源至国家一级标准物质GBW09178。
[储存条件及有效期]
1.原包装试剂在2℃~8℃避光贮存,有效期12个月。
2.试剂开盖后在2℃~8℃避光保存,稳定期30天。
3.原包装校准品在2℃~8℃避光贮存,有效期36个月。
4.校准品复溶后在2℃~8℃避光、密闭贮存,使用有效期为5天。
[适用仪器]
本试剂盒适用于HITACHI 7180/7170/7060/7080/7600、 BECKMAN DXC-800、OLYMPUS AU400/640/2700/5400和TOSHIBA 40FR/120FR全自动生化分析仪。
[样本要求]
1.样本种类:新鲜无溶血血清。
2.样本采集:取静脉血3.0ml,置于玻璃试管中。样本采集后,立即密封送检。
3.样本干扰:对反应吸光度有干扰的样本,包括溶血和浑浊的样本都可能影响检测结果,遇上述情况建议重新采集。
4.样本保存:样本2℃~8℃可稳定7天;-25℃~-15℃可保存1个月,忌反复冻融。
[检测方法]
1.试剂准备:试剂开瓶即可使用,校准品需用1.0ml纯化水复溶后方可使用。
2.检测步骤:
(1)基本操作步骤:波长:600nm(540nm~620nm);反应温度:37℃;比色杯光径:1cm。
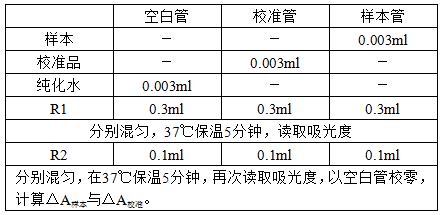
(2)全自动生化分析仪检测步骤:参数设置→试剂装载→校准→质控→样本加载→仪器计算→结果审核→报告。具体参数详见“参考参数表”。
3.校准:应使用试剂盒配套的校准品,校准周期为30天;当试剂更换批号、质控出现漂移、仪器做完保养、重要零件更换时应重新进行校准。
4.质量控制:每天对样本进行检测之前,须进行质量控制,以保障测试系统的稳定性。可采用日本积水医疗的校准品进行室内控制,测定结果应在允许范围内。若超出控制范围,需查找原因,如仪器、试剂与质控品的状态或参数设置等。
5.检验结果的计算: 生化分析仪将自动给出检验结果。
转换因数:mg/dl×0.02586 = mmol/L
mmol/L×38.67 = mg/dl
[参考范围]
根据参考文献[3],结合本公司验证,LDL-C的参考范围为:

各医院应根据本地区实际情况建立自己的参考范围。
[检验结果的解释]
专业人员负责检验结果的审核。检验结果会受到受检者年龄、性别、体重等的影响。通常情况下,其结果如在参考范围内,认为正常;如在临界区域内,应重新测定进行确认;如明显超出参考范围或确认检测后仍超出参考范围,则认为血清低密度脂蛋白胆固醇浓度异常。检验结果如出现与临床不符甚至相悖的情况,应分析与查找原因。
[检验方法的局限性]
1.胆红素≤10mg/dl时,对测定结果没有明显干扰。
2.抗坏血酸≤50mg/dl时,对测定结果没有明显干扰。
3.乳糜(Intralipid)≤250mg/dl时,对测定结果没有明显干扰。
4.血红蛋白≤1000mg/dl时,对测定结果没有明显干扰。
5.检测结果与所使用的仪器种类和型号相关,使用不同的仪器,检测结果可能会有差异。
[产品性能指标]
1.试剂空白吸光度:在波长600nm(540nm~620nm)(光径1cm)处,试剂空白吸光度A≤0.080。
2.准确度:型式检验:测定国家一级标准物质GBW09178,测定结果的相对偏差应不超过±10%。
出厂检验:检测日本积水医疗校准品(Cholestest N Calibrator),测定结果的相对偏差应不超过±10%。
3.分析灵敏度:浓度为2.59mmol/L(100mg/dl)的LDL-C所产生的吸光度差值(△A)应在0.080~0.350范围内。
4.重复性:测定值的变异系数(CV)应≤5%。
5.批间差:试剂盒的批间差(R)应≤5%。
6.线性范围:在[0.30mmol/L~10.34mmol/L]范围内,线性相关系数(r)应≥0.990;在[3.00mmol/L~10.34mmol/L]范围内,线性相对偏差应不超过±10%;在[0.30mmol/L~3.00mmol/L]范围内,线性绝对偏差应不超过±0.30mmol/L。
7.校准品瓶间差:校准品批内瓶间差变异系数(CV)应≤3%。
[注意事项]
1.试剂避免直接接触皮肤和眼睛,切勿吞咽。
2.使用前应该认真阅读产品说明书,使用后的器具须按照相关医疗废弃物的处理规定处理。
3.由于运输过程产生渗液或漏液的产品,或在运输贮存中没有按照说明书要求进行维护的试剂,不可使用。
4.本产品仅适用于临床体外诊断,需专业人员使用。
5.如医院使用其它型号的全自动生化分析仪,请各医院根据实际需要进行验证。
6.本产品校准品基质为人血清,所有人体材料都应认为具有潜在的传染性。虽然所有来自健康供血者的血液制品都经过检测,并证实HBsAg以及HCV抗体和HIV抗体为阴性,然而没有一种检测方法可绝对可靠地排除潜在的感染危险。因此,本产品应与病人标本等同对待,所有实验操作都应注意常规防范。
[标签中图标解释]
[参考文献]
1.陆永绥、李清华、张伟民主编,临床检验自动化仪器分析标准操作规程,浙江大学出版社,2006。
2.陆永绥、张伟民主编,临床检验管理和技术规程,浙江大学出版社,2004。
3.中华人民共和国卫生部医政司,全国临床检验操作规程(第3版),东
南大学出版社,2006。
4.王惠萱、李雪梅、王珂主编,临床检验标本采集手册,云南科技出版社,2008。
[生产企业]
企业名称:中生北控生物科技股份有限公司
注册地址:北京市昌平区科技园区超前路27号
生产地址:北京市昌平区科技园区超前路27号
邮 编:102200
[医疗器械生产企业许可证编号]
京药监械生产许20000271号
[医疗器械注册证书编号]
京药监械(准)字2013第2401047号
[产品标准编号]
YZB/京 0125-2013
[说明书批准日期及修改日期]
2013年9月29日






 所有类目
所有类目